嵌合抗原受体T细胞疗法(CAR-T)在血液瘤治疗中取得了突破性进展,但在实体瘤中的应用仍然受限。近日,华东师范大学刘明耀教授、杜冰教授团队在Cancer Cell杂志上发表了题为CAR-T therapy in solid tumors的综述,汇总了目前CAR-T细胞在多种实体瘤临床研究中的突破性进展,探讨了CAR-T细胞在治疗实体瘤中面临的挑战,并对突破实体瘤治疗瓶颈的策略进行了全方位总结。

在本综述中,作者首先对多种实体瘤的常规治疗手段进行了总结,并阐述了针对不同靶点的CAR-T细胞在治疗实体瘤中所取得的突破性进展。在一项肺癌治疗的临床研究中,相较于传统治疗手段靶向EGFR的CAR-T细胞将患者的中位生存期提升至15.63个月。而针对肝癌的GPC3-CAR-T、胃癌的CLDN18.2-CAR-T在临床研究中显示出高达90%以上的疾病控制率。用于治疗前列腺癌的PSMA CAR-T可以将患者前列腺癌特异性抗原的水平下降95%以上。接受MSLN-CAR-T治疗的卵巢癌患者以及接受GD2 CAR-T治疗的恶性胶质瘤患者,6个月总生存率、12个月总生存率分别达到了70.2%和83.3%。尽管这些创新性CAR-T疗法在少数实体瘤患者中展示出了巨大潜力,但其整体的临床疗效仍有待提升。
随后作者分析了CAR-T细胞治疗实体瘤面临的挑战,具体包括:
1、持续暴露于肿瘤抗原导致的T细胞耗竭。肿瘤抗原的反复刺激以及CAR-T细胞存在的强直信号使得CAR-T细胞过度激活并向耗竭表型分化。
2、正常细胞上表达的肿瘤抗原引起的中靶脱瘤毒性。由于实体瘤的靶点多为肿瘤相关抗原,而这些靶点也在正常组织中表达,因此CAR-T细胞可能会破坏正常组织,引发毒副作用。
3、免疫抑制的肿瘤微环境。缺氧、营养物质匮乏的微环境不利于免疫细胞存活,且肿瘤微环境中肿瘤细胞以及MDSC、Treg等免疫抑制细胞表达的负向免疫检查点分子和分泌的免疫抑制因子如TGFβ等抑制CAR-T细胞的免疫反应。
4、CAR-T细胞难以迁移并浸润至实体肿瘤病灶。实体瘤具备纤维组织的物理屏障,加之趋化因子表达匮乏,不利于CAR-T细胞的定位和浸润。
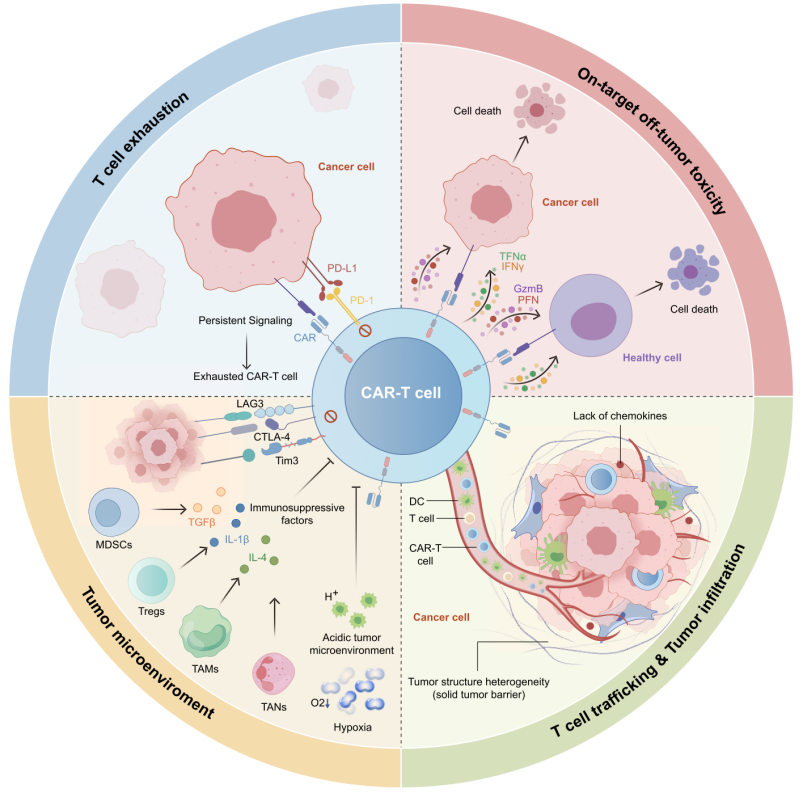
图1. CAR-T疗法在实体瘤中的挑战
最后,作者对优化并提升CAR-T细胞治疗实体瘤的相关研究进展进行了归纳与总结。主要围绕以下几点①新型CAR结构的设计、开发更有效且安全的合成受体:CAR设计中共刺激分子的引入以提升CAR-T持久性、调节CAR电荷密度以优化基底信号并提升抗肿瘤能力以及整合CAR-T和TCR-T技术——STAR-T,其表现出更好的肿瘤浸润性和更高的抗原敏感性。②增强CAR-T细胞功能:与CAR-T功能相关的正向或负向转录因子以及表观调控因子等的过表达或敲除,IL-10、FOXO1的过表达,增强了CAR-T细胞的干性,提升CAR-T细胞对肿瘤细胞的清除以及长期控制能力,REGNASE-1、NR4A基因的敲除,延长了CAR-T细胞的生存功能以实现更好的抗肿瘤效应,免疫检查点的工程化改造将免疫检查点的胞内正向信号传导结构域保留并破坏胞内负向信号转导结构域以提升CAR信号传导,增强CAR-T效力。③创新CAR-T细胞的制备工艺:通用型CAR-T细胞的制备以降低自体CAR-T细胞的制备周期,非病毒定点整合CAR-T的应用以提升CAR整合的安全性同时增强CAR-T细胞功能,体内CAR-T的生成极大的简化了生产工艺。④克服肿瘤免疫微环境的限制:CAR-T细胞额外装载分泌型因子或敲除免疫抑制性受体、负向转录因子以实现破坏肿瘤外基质、提升CAR-T细胞向实体瘤的迁移及其存活能力,CAR-T细胞过表达IL-7和CCL19提升CAR-T细胞向实体肿瘤的浸润并提升CAR-T细胞在实体肿瘤中的存活,增强对肿瘤细胞的杀伤,LIGHT、肝素酶的分泌可实现破坏肿瘤外基质或重塑肿瘤异常的脉管系统以提升CAR-T细胞向实体肿瘤的定植能力。⑤提升CAR-T细胞治疗的安全性:双靶点CAR-T细胞的设计与改造以降低中靶脱瘤毒性,安全开关的引入以及细胞因子风暴相关通路的阻断,IL-1、IL-6阻断降低了患者CRS的风险。
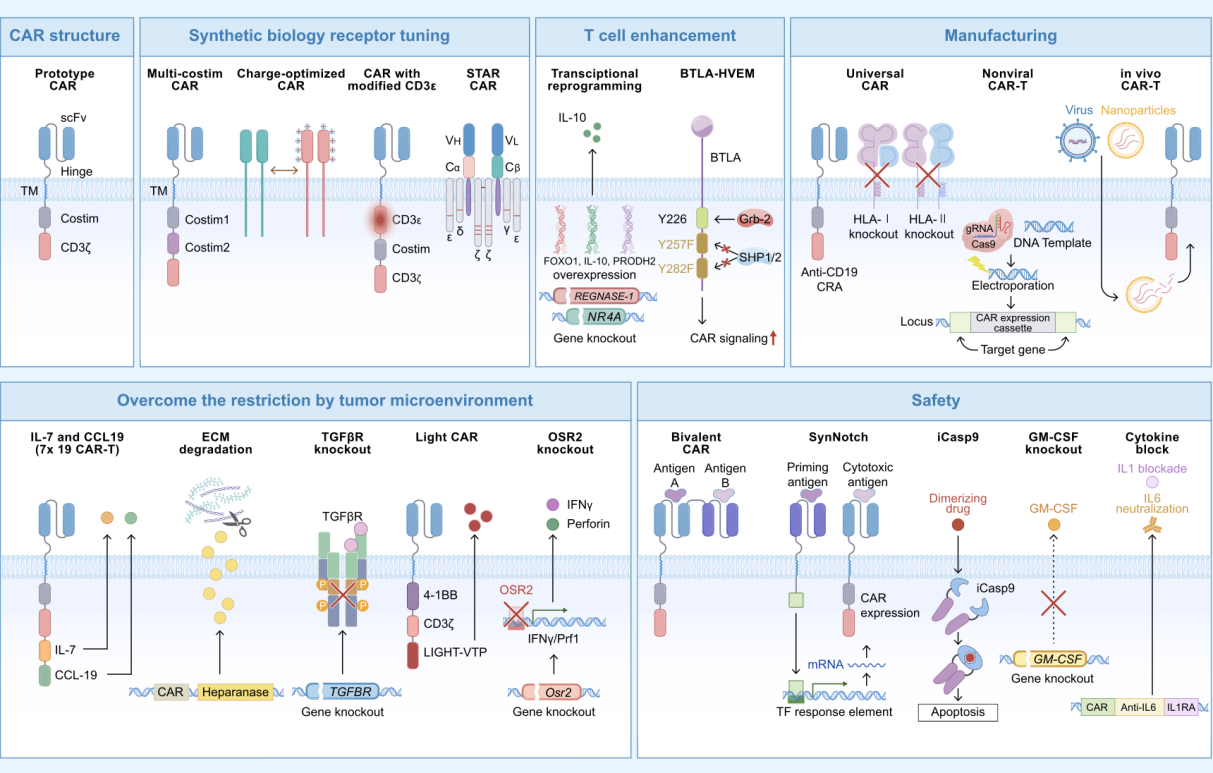
图2.克服实体瘤障碍的策略
近年来,随着对肿瘤免疫微环境以及T细胞功能调控机制认识的不断深入,对于CAR-T细胞的改造也越来越系统化、多样化,使CAR-T细胞在实体肿瘤的临床治疗中不断取得突破性的进展,相信随着基因编辑、合成生物学、肿瘤免疫学研究的飞速发展,CAR-T细胞一定会成为实体肿瘤治疗的有力武器。
原文链接:
https://doi.org/10.1016/j.ccell.2025.03.019

